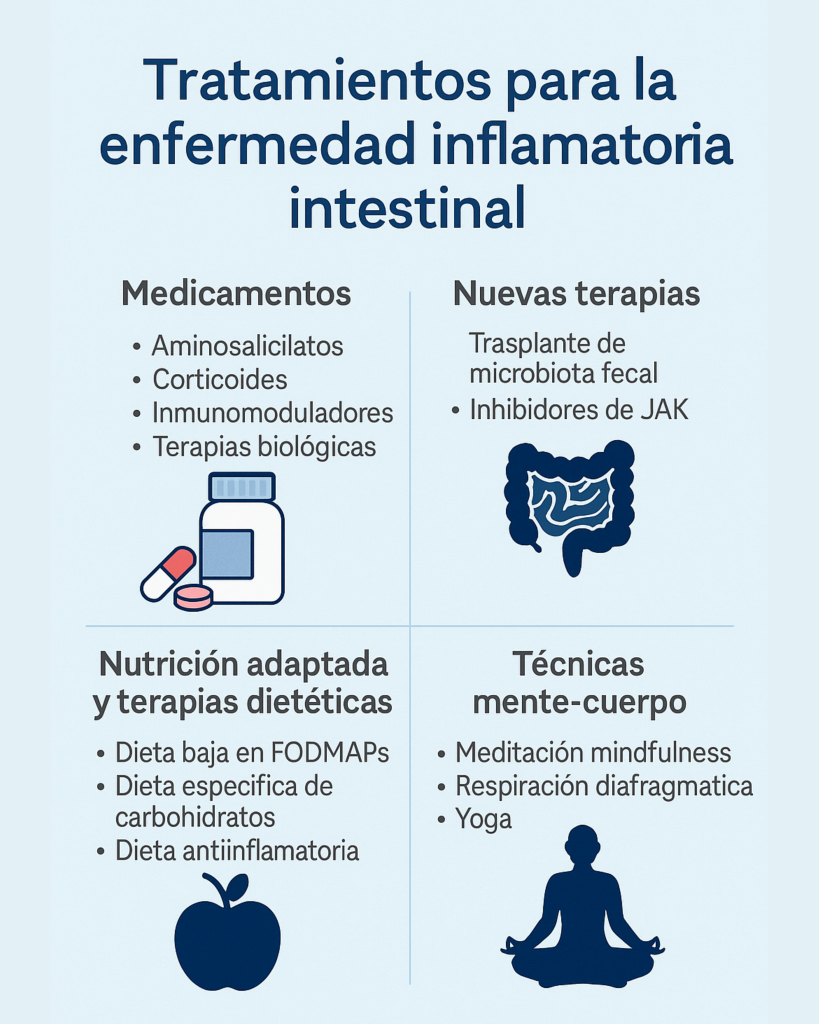
Vivir con una enfermedad inflamatoria intestinal no es solo una cuestión digestiva. Es una experiencia que compromete tu sistema inmune, tus emociones, tu energía y, muchas veces, tu forma de relacionarte con el mundo. Por eso, cuando hablamos de tratamientos para la enfermedad inflamatoria intestinal, no estamos hablando únicamente de pastillas o inyecciones: hablamos de un abordaje integral que necesita ser tan diverso como lo son los síntomas y las historias detrás de cada diagnóstico.
Hoy en día, los tratamientos para la enfermedad inflamatoria intestinal abarcan desde las terapias farmacológicas clásicas (como los corticoides o los inmunosupresores), hasta los modernos fármacos biológicos, suplementos con evidencia clínica, enfoques nutricionales personalizados y prácticas que regulan el sistema nervioso, como la meditación o el ejercicio. No existe una única fórmula válida para todos. Cada tratamiento debe adaptarse a la persona, a su fase de la enfermedad, a su estilo de vida y, sobre todo, a su respuesta individual.
Además, es importante recordar que muchos pacientes transitan un largo camino hasta encontrar un tratamiento que funcione. A veces se avanza, otras se retrocede, pero lo que nunca puede faltar es el conocimiento y la autonomía para participar activamente en las decisiones. Conocer bien las opciones de tratamiento para la enfermedad inflamatoria intestinal es clave para evitar errores, reducir el sufrimiento innecesario y sostener una remisión estable a largo plazo.
Este artículo nace con ese propósito: ofrecer una comparativa clara, actualizada y útil sobre los principales tratamientos para la enfermedad inflamatoria intestinal, para que puedas entender mejor qué hay disponible, cómo actúa cada opción y qué ventajas o limitaciones tiene en cada caso. Ya sea que estés comenzando el tratamiento, en busca de alternativas, o simplemente quieras aprender más para cuidar tu salud de forma proactiva, este contenido está hecho para ayudarte a tomar decisiones más seguras y conscientes.
Mesalazina, Sulfasalazina, Olsalazina, Balsalazida. Aminosalicilatos (5-ASA)
Terapias médicas para Crohn y colitis ulcerosa
Dentro de los tratamientos para la enfermedad inflamatoria intestinal, los aminosalicilatos son la primera línea para casos leves, especialmente en colitis ulcerosa. El más conocido es la mesalazina, pero también se emplean sulfasalazina, balsalazida y olsalazina.
Estos fármacos actúan de forma local reduciendo la inflamación en la mucosa del colon, sin afectar tanto al resto del cuerpo. Por eso, se consideran seguros y bien tolerados en la mayoría de pacientes. Son eficaces para inducir y mantener la remisión en colitis ulcerosa leve a moderada, pero tienen poca eficacia en enfermedad de Crohn, sobre todo cuando afecta al intestino delgado.
Se pueden administrar por vía oral o rectal (supositorios, enemas), dependiendo de la localización del brote. Esta personalización es clave para que los tratamientos para la EII sean efectivos y bien dirigidos.
Entre sus ventajas destacan el bajo perfil de efectos secundarios y su uso prolongado sin grandes riesgos. Sin embargo, no son útiles en brotes graves ni en pacientes que requieren inmunosupresión o terapia biológica.
En resumen, los aminosalicilatos son útiles en fases leves de colitis ulcerosa, no tanto en Crohn, y representan una de las opciones más accesibles y seguras dentro de los tratamientos para la enfermedad inflamatoria intestinal. Para muchos pacientes, son el primer paso en un camino que puede volverse más complejo, pero que bien llevado, puede estabilizar la enfermedad durante años.
Prednisona, Budesonida, Metilprednisolona, Hidrocortisona, Beclometasona. Corticoides
Los corticoides son uno de los tratamientos para la enfermedad inflamatoria intestinal más eficaces a corto plazo, pero también uno de los que más precauciones requiere. Su función principal es controlar la inflamación intensa durante los brotes agudos, cuando los síntomas se disparan y la calidad de vida se deteriora rápidamente.
Fármacos como la prednisona, la budesonida o la metilprednisolona actúan suprimiendo el sistema inmune de forma potente. Esto permite reducir el sangrado, el dolor abdominal y la diarrea en pocos días. Es, en muchos casos, la forma más rápida de recuperar el control en una fase activa de Crohn o colitis ulcerosa.
Sin embargo, estos tratamientos para la EII no están exentos de efectos adversos. Usados durante mucho tiempo o en dosis elevadas, pueden provocar insomnio, hinchazón, pérdida de masa muscular, osteoporosis, ansiedad, hipertensión, acné, entre otros. Además, no curan ni modifican el curso de la enfermedad, solo “apagan el incendio” de forma temporal.
La budesonida, una versión de corticoide con efecto localizado en el intestino, se utiliza con frecuencia en enfermedad de Crohn ileal o colónica derecha. Tiene menos efectos sistémicos, pero su uso también debe ser limitado en el tiempo.
Por eso, los corticoides deben verse como una herramienta transitoria dentro del abanico de tratamientos para la enfermedad inflamatoria intestinal. Se usan para salir de un brote, pero deben retirarse progresivamente y sustituirse por opciones de mantenimiento más seguras, como los inmunomoduladores o los tratamientos biológicos.
En resumen, los corticoides son eficaces, rápidos y necesarios en muchas situaciones, pero nunca deben convertirse en una muleta crónica. En el manejo moderno de la EII, la prioridad es usarlos lo justo y lo menos posible.
Azatioprina, Mercaptopurina (6-MP), Metotrexato, Ciclosporina, Tacrolimus. Inmunomoduladores
Los inmunomoduladores ocupan un lugar estratégico entre los tratamientos para la enfermedad inflamatoria intestinal, especialmente cuando se busca mantener la remisión y reducir la dependencia de los corticoides. No actúan rápido, pero son potentes a largo plazo y pueden cambiar el curso de la enfermedad.
Los más utilizados son la azatioprina, la mercaptopurina y el metotrexato. Todos ellos modulan la respuesta inmunitaria, frenando la reacción inflamatoria crónica que caracteriza tanto a la colitis ulcerosa como a la enfermedad de Crohn.
A diferencia de los corticoides, estos tratamientos para la EII no están diseñados para resolver un brote agudo, sino para prevenir recaídas y mantener la estabilidad clínica una vez que se ha alcanzado la remisión. Su principal ventaja es que permiten “bajar de marcha” el sistema inmunológico sin necesidad de usar biológicos en algunos casos.
Sin embargo, su uso exige paciencia: pueden tardar entre 8 y 12 semanas en hacer efecto. Además, requieren monitoreo analítico frecuente, ya que pueden afectar al hígado, disminuir las defensas o alterar el recuento de glóbulos blancos. También es importante evaluar la actividad de la enzima TPMT antes de iniciar el tratamiento, especialmente con azatioprina o mercaptopurina.
El metotrexato, por su parte, se utiliza más en enfermedad de Crohn que en colitis ulcerosa, y suele administrarse por vía subcutánea una vez por semana. En mujeres, requiere especial precaución si hay intención de embarazo, ya que es teratogénico.
En algunos casos, los inmunomoduladores se combinan con terapias biológicas para potenciar la eficacia del tratamiento y reducir el riesgo de generar anticuerpos contra el biológico. Esta estrategia, conocida como terapia combinada, se ha convertido en una práctica habitual cuando se busca una remisión profunda.
En resumen, los inmunomoduladores son tratamientos para la enfermedad inflamatoria intestinal de acción lenta pero muy valiosa, especialmente para pacientes que necesitan controlar la inflamación de forma sostenida y reducir el uso crónico de otros fármacos más agresivos.
Biológicos clásicos
Cuando los tratamientos convencionales no son suficientes o la enfermedad es moderada o grave desde el inicio, los biológicos clásicos se convierten en una de las opciones más eficaces dentro de los tratamientos para la enfermedad inflamatoria intestinal.
Estos fármacos son anticuerpos monoclonales diseñados para bloquear de forma específica moléculas que promueven la inflamación. En el caso de los biológicos clásicos, el objetivo principal es el factor de necrosis tumoral alfa (TNF-α), una de las sustancias inflamatorias más implicadas en la EII.
Los tres más utilizados en este grupo son:
- Infliximab (administrado por vía intravenosa).
- Adalimumab (autoinyectable subcutáneo).
- Golimumab (menos frecuente, especialmente en colitis ulcerosa).
Estos tratamientos para la EII han demostrado su eficacia en la inducción y el mantenimiento de la remisión, así como en la cicatrización mucosa, lo cual es un objetivo terapéutico cada vez más valorado. También son eficaces en complicaciones como las fístulas en enfermedad de Crohn, donde infliximab tiene un rol destacado.
No obstante, su uso implica ciertos riesgos. Al ser inmunosupresores potentes, pueden aumentar la susceptibilidad a infecciones, reactivar virus latentes como la tuberculosis o el VHB, y en casos raros generar reacciones adversas graves. Además, con el tiempo algunos pacientes desarrollan anticuerpos anti-fármaco, lo que reduce su eficacia. Por eso, en muchos casos se combinan con inmunomoduladores para evitar este problema.
El control médico debe ser riguroso: analíticas frecuentes, revisión de vacunación previa y seguimiento clínico estrecho. Son medicamentos caros, por lo que en muchos sistemas de salud se requiere autorización específica o indicación hospitalaria.
En resumen, los biológicos clásicos son una herramienta esencial en los tratamientos para la enfermedad inflamatoria intestinal, especialmente en casos de difícil control. Su eficacia es alta, pero deben utilizarse con criterios claros, buena monitorización y siempre individualizando la elección según el perfil del paciente.
Vedolizumab, Ustekinumab, Risankizumab, Ozanimod, Etrasimod. Nuevos biológicos y terapias dirigidas
Abordajes clínicos en enfermedad inflamatoria intestinal
En los últimos años, la investigación ha ampliado el abanico de tratamientos para la enfermedad inflamatoria intestinal con la llegada de nuevos biológicos más específicos y con mejor perfil de seguridad. Estos fármacos ofrecen alternativas eficaces a quienes no responden o no toleran los biológicos clásicos anti-TNF.
Dentro de esta nueva generación, destacan principalmente dos mecanismos de acción:
1. Anticuerpos contra integrinas (anti-integrina)
Vedolizumab es el representante más conocido de este grupo. Actúa bloqueando la migración de células inmunitarias al intestino, pero sin suprimir la inmunidad sistémica. Es decir, modula la inflamación intestinal sin afectar otras partes del cuerpo, lo que reduce el riesgo de infecciones o efectos adversos en órganos no digestivos.
Esto convierte a vedolizumab en uno de los tratamientos para la EII con mejor tolerancia a largo plazo, especialmente útil en pacientes con historial de infecciones o comorbilidades que desaconsejan otros biológicos.
2. Anticuerpos contra interleucinas (anti-IL-12/23)
Ustekinumab y más recientemente risankizumab se dirigen contra interleucinas claves en la inflamación crónica del intestino. Su uso está aprobado principalmente en enfermedad de Crohn, aunque ustekinumab también ha demostrado eficacia en colitis ulcerosa.
Ambos permiten tratar la EII desde un enfoque más específico, con buena respuesta en pacientes que han fallado a terapias previas, y con un perfil de efectos secundarios más reducido que los anti-TNF. Además, su pauta de administración suele ser más cómoda: una dosis intravenosa inicial, seguida de inyecciones subcutáneas cada 8 o 12 semanas.
En conjunto, estos fármacos representan una evolución significativa en los tratamientos para la enfermedad inflamatoria intestinal, al ofrecer una mayor precisión, menos efectos secundarios sistémicos y nuevas esperanzas para quienes no logran control con terapias tradicionales.
La elección entre uno u otro dependerá del tipo de EII, la localización, el historial de respuesta previa, la presencia de efectos adversos y factores individuales como edad, comorbilidades o deseos reproductivos. Como siempre, el tratamiento debe ser tan único como la persona que lo recibe.
Terapias emergentes: pequeñas moléculas (inhibidores de JAK)
En el campo de los tratamientos para la enfermedad inflamatoria intestinal, las llamadas pequeñas moléculas representan una de las innovaciones más recientes. A diferencia de los biológicos —que son anticuerpos de gran tamaño administrados por vía parenteral—, estas moléculas son fármacos orales que actúan de forma selectiva sobre rutas intracelulares de señalización inflamatoria.
Los más conocidos son los inhibidores de JAK (Janus Kinasa), como el tofacitinib y el upadacitinib. Están diseñados para bloquear las señales inflamatorias que activan el sistema inmunitario, frenando así el proceso inflamatorio desde el interior de la célula.
Actualmente, tofacitinib está aprobado para colitis ulcerosa moderada a grave en adultos que no han respondido a otras terapias, mientras que upadacitinib, más reciente y más selectivo (JAK1), ya ha demostrado eficacia tanto en colitis ulcerosa como en enfermedad de Crohn.
Lo interesante de estas opciones es su administración oral, lo que mejora la comodidad y adherencia del paciente. Además, tienen un inicio de acción más rápido que algunos biológicos y no generan anticuerpos neutralizantes, una complicación común en las terapias con proteínas.
Sin embargo, no están exentos de riesgos. Estos tratamientos para la EII requieren un control estricto, ya que pueden aumentar el riesgo de infecciones, alteraciones en lípidos, trombosis y otros efectos adversos, especialmente en pacientes mayores o con factores de riesgo cardiovascular.
Por eso, las pequeñas moléculas se consideran una opción potente, pero selectiva, reservada para quienes no responden o no toleran otros tratamientos para la enfermedad inflamatoria intestinal, o cuando se busca una pauta oral con alta eficacia.
En resumen, los inhibidores de JAK abren una nueva vía en el manejo de la EII: más flexible, más rápida y con mecanismos distintos a los clásicos. Su llegada amplía las posibilidades, pero también exige una valoración médica detallada antes de su indicación.
Comparativa de medicamentos en los tratamientos para la enfermedad inflamatoria intestinal
Formas de tratar la enfermedad inflamatoria intestinal
| Grupo de fármaco | Ejemplos | Beneficios | Actuación | Efectos secundarios frecuentes |
|---|---|---|---|---|
| Aminosalicilatos (5-ASA) | Mesalazina, sulfasalazina | – Control de inflamación leve en colitis – Buena tolerancia – Uso prolongado | Antiinflamatorio local sobre mucosa intestinal (colon) | Cefaleas, náuseas, erupciones cutáneas, toxicidad renal (rara) |
| Corticoides | Prednisona, budesonida | – Rápida reducción de brotes – Mejora clínica en pocos días | Inmunosupresión sistémica (prednisona) o localizada (budesonida) | Insomnio, hipertensión, aumento de peso, osteoporosis, ansiedad |
| Inmunomoduladores | Azatioprina, 6-MP, metotrexato | – Mantenimiento a largo plazo – Reducción del uso de corticoides | Modulación de linfocitos T Bloqueo de síntesis de ADN en células inmunes | Náuseas, toxicidad hepática, leucopenia, riesgo de infecciones |
| Biológicos clásicos (anti-TNF) | Infliximab, adalimumab, golimumab | – Alta eficacia en brotes moderados a graves – Cicatrización mucosa – Mejora de fístulas | Bloqueo del TNF-α, principal mediador inflamatorio sistémico | Riesgo de infecciones, reacciones infusionales, desarrollo de anticuerpos |
| Nuevos biológicos | Vedolizumab, ustekinumab, risankizumab | – Mayor especificidad – Menor inmunosupresión sistémica – Buena respuesta en refractarios | – Vedolizumab: anti-integrina (bloqueo de migración leucocitaria) – Ustekinumab/Risankizumab: anti-IL-12/23 | Infecciones leves, cefalea, náuseas, riesgo menor de reacciones graves |
| Pequeñas moléculas (JAKi) | Tofacitinib, upadacitinib | – Administración oral – Inicio rápido – Alternativa en resistentes a biológicos | Inhibición de la señalización de citocinas inflamatorias JAK-STAT | Trombosis, infecciones, elevación de lípidos, riesgo cardiovascular |
Trasplante de microbiota fecal (TMF)
Dentro de los tratamientos para la enfermedad inflamatoria intestinal, el trasplante de microbiota fecal (TMF) representa una de las líneas más innovadoras y, a la vez, más controversiales. Esta terapia se basa en una idea poderosa: restaurar un ecosistema intestinal sano introduciendo bacterias beneficiosas de un donante sano en el intestino de un paciente con EII.
Aunque el concepto puede parecer extremo o incluso desagradable para algunos, tiene una lógica científica sólida. La disbiosis intestinal, es decir, el desequilibrio de la microbiota, está estrechamente ligada a los procesos inflamatorios crónicos que caracterizan a la colitis ulcerosa y a la enfermedad de Crohn. Por eso, devolver diversidad y funcionalidad al ecosistema microbiano se considera una intervención terapéutica prometedora.
Los estudios actuales muestran resultados moderadamente positivos en colitis ulcerosa, especialmente en pacientes con enfermedad leve a moderada y sin tratamiento inmunosupresor. Algunos ensayos han demostrado tasas de remisión clínica y mucosa superiores al placebo tras varias infusiones de microbiota bien seleccionada.
En cambio, en enfermedad de Crohn los resultados son más inconsistentes y aún no permiten establecer una pauta terapéutica estándar. Por el momento, el TMF no forma parte de los tratamientos para la EII de uso rutinario, aunque sí se está explorando en ensayos clínicos y en programas de uso compasivo en centros especializados.
El procedimiento puede realizarse por vía endoscópica, cápsulas orales o enemas, dependiendo del protocolo y de la localización de la enfermedad. Pero lo más importante es la calidad y perfil del donante, así como la manipulación de la muestra, ya que un TMF mal preparado puede acarrear riesgos infecciosos o respuestas inmunes no deseadas.
Por ahora, el TMF no sustituye a otros tratamientos para la enfermedad inflamatoria intestinal, pero sí puede actuar como complemento o alternativa experimental en casos seleccionados, especialmente cuando el componente microbiano parece ser clave.
En resumen: el trasplante de microbiota fecal es una terapia emergente que refleja el avance hacia un enfoque más ecológico y personalizado de la salud intestinal. Prometedor, sí. Pero aún con limitaciones y sin evidencia concluyente para sustituir los tratamientos establecidos.
Terapias personalizadas basadas en genética y microbioma
El futuro de la EII es individual
Los avances en genética, epigenética y microbiología están abriendo una nueva era en los tratamientos para la enfermedad inflamatoria intestinal: la medicina de precisión. Cada vez es más evidente que no existen dos personas con EII iguales. La forma en la que se manifiesta la enfermedad, cómo responde al tratamiento o qué la desencadena está influida por factores genéticos, ambientales y microbianos únicos en cada individuo.
Las terapias personalizadas buscan aprovechar esa información. Ya no se trata solo de suprimir la inflamación, sino de entender por qué se activa en primer lugar. Para eso, se estudia el perfil genético del paciente, su tipo de microbiota, la integridad de la barrera intestinal, su historia clínica y sus desencadenantes ambientales o emocionales.
Aunque aún en desarrollo, esta línea de trabajo ha permitido, por ejemplo, identificar subgrupos de pacientes que responden mejor a ciertos biológicos, predecir el riesgo de efectos adversos, o incluso modular la dieta según la composición del microbioma para reducir la inflamación.
En este enfoque, los tratamientos para la EII ya no son generalistas. Se adaptan al paciente. Se combinan probióticos específicos con dieta antiinflamatoria, suplementos dirigidos, ajustes farmacológicos y estrategias de regulación del sistema nervioso. Es decir, se trata a la persona, no solo al intestino.
Algunos centros de investigación están incluso probando algoritmos que integran datos de genética, microbiota y respuesta inmune para predecir qué tratamiento será más eficaz antes de empezarlo. Esto evitaría meses —o años— de ensayo y error, mejorando los resultados clínicos y reduciendo los efectos secundarios.
Aunque la medicina personalizada aún no es estándar en todos los sistemas de salud, representa sin duda el futuro de los tratamientos para la enfermedad inflamatoria intestinal. Un futuro más eficiente, más humano y más respetuoso con la biología única de cada paciente.
Suplementación con evidencia
¿Por qué suplementar en la EII?
Dentro de los tratamientos para la enfermedad inflamatoria intestinal, la suplementación no sustituye a la medicación, pero puede marcar una diferencia real en la evolución, el bienestar y la calidad de vida del paciente. Algunos suplementos cuentan con respaldo científico suficiente como para considerarse parte de un abordaje integrador. No es lo mismo tomar “cosas naturales” al azar que hacerlo con propósito, evidencia y una buena estrategia detrás.
Glutamina
La glutamina es uno de los aminoácidos más importantes para la salud intestinal. Sirve como principal fuente de energía para los enterocitos (las células del intestino) y favorece la reparación de la mucosa. En pacientes con EII, sobre todo durante o tras un brote, la glutamina puede ayudar a mejorar la integridad de la barrera intestinal y reducir la permeabilidad. Su uso es especialmente relevante en casos de desnutrición, cirugía reciente o tras pérdidas importantes de peso.
Creatina
Aunque tradicionalmente vinculada al rendimiento deportivo, la creatina tiene propiedades antiinflamatorias, mejora la función mitocondrial y puede ayudar a conservar masa muscular en personas con EII que han estado inactivas o han sufrido pérdida de peso. Además, se ha observado que la creatina podría tener efectos beneficiosos en el intestino al apoyar el metabolismo energético en tejidos dañados, lo que la convierte en un suplemento interesante dentro de los tratamientos para la EII.
Proteína en polvo
La proteína en polvo —especialmente en forma de batidos bien tolerados— no es solo un suplemento, sino una comida funcional. Es útil cuando hay fatiga, poca tolerancia digestiva o dificultad para masticar, digerir o preparar comidas sólidas. Además de ayudar a cubrir requerimientos proteicos, reduce el estrés digestivo si se elige una fórmula sin lactosa, sin fibra y con digestión rápida (por ejemplo, aislado de suero o hidrolizado). Es una aliada diaria para mantener o recuperar masa muscular sin sobrecargar el intestino.
Cúrcuma
La cúrcuma, y en concreto su principio activo, la curcumina, posee efectos antiinflamatorios bien documentados. Se ha observado que puede modular el NF-kB (un regulador clave de la inflamación intestinal) y ayudar a reducir la actividad inflamatoria en colitis ulcerosa leve a moderada. Aunque por sí sola no reemplaza la medicación, puede ser útil como terapia de mantenimiento. Es importante tomarla con piperina (extracto de pimienta negra) o en formas liposomadas para mejorar su absorción.
Ashwagandha
La ashwagandha es un adaptógeno que actúa sobre el eje hipotalámico-pituitario-adrenal, ayudando a regular la respuesta al estrés. En personas con EII, donde el estrés y la inflamación se retroalimentan, su uso puede mejorar el descanso, reducir la ansiedad anticipatoria a los síntomas y proteger contra el agotamiento suprarrenal. Aunque no es antiinflamatoria intestinal directa, es una herramienta muy valiosa como complemento emocional y neurológico dentro de los tratamientos para la enfermedad inflamatoria intestinal.
En conjunto, estos suplementos no son una moda, ni una panacea. Son herramientas que, cuando se eligen bien, se dosifican correctamente y se integran en una estrategia global, potencian el efecto de los tratamientos para la EII, reducen síntomas asociados (fatiga, ansiedad, pérdida muscular) y contribuyen a una recuperación más sólida.
Eso sí, no todo el mundo necesita todo, ni todo sirve para todos. Por eso, como siempre, el enfoque debe ser personalizado y supervisado.
Nutrición adaptada y terapias dietéticas
Cómo controlar tu EII de forma efectiva
La nutrición no es un detalle en el tratamiento de la EII. Es un pilar. Cada vez hay más evidencia de que una dieta bien planteada puede reducir síntomas, mejorar la calidad de vida y disminuir la inflamación intestinal. Por eso, cuando hablamos de tratamientos para la enfermedad inflamatoria intestinal, la alimentación debe ocupar un lugar prioritario, al mismo nivel que los fármacos o la suplementación.
El principal error suele ser aplicar dietas genéricas o restrictivas sin estrategia. Lo que funciona en una persona puede sentarle fatal a otra. Y no se trata solo de “comer sano”, sino de comer según tu intestino, tu microbiota, tu energía y tu fase actual de la enfermedad.
Adaptación según fase clínica
Compra mi libro en España, Latinoamérica y EEUU: https://editorialsaralejandria.com/

En brotes agudos, la prioridad es reducir el volumen digestivo, evitar residuos, controlar la diarrea y garantizar absorción. Aquí funcionan bien:
- cremas de arroz o avena,
- purés sin piel ni semillas,
- carnes y pescados blancos,
- y líquidos claros con electrolitos.
En remisión, el objetivo cambia: reconstruir, nutrir y diversificar. Se pueden reintroducir gradualmente alimentos más ricos en fibra soluble (como avena, chía, calabaza cocida o plátano maduro), aumentar las grasas saludables (aguacate, AOVE) y personalizar los carbohidratos complejos según tolerancia.
Enfoques dietéticos útiles
- Dieta baja en FODMAPs: útil en pacientes con SII post-EII o con sensibilidad a fermentaciones intestinales. Se aplica de forma temporal y con supervisión.
- SCD (Specific Carbohydrate Diet): enfoque más restrictivo que elimina disacáridos y polisacáridos fermentables. Puede mejorar síntomas en Crohn, pero requiere acompañamiento profesional.
- Dieta antiinflamatoria personalizada: enfoque integrador que adapta alimentos según marcadores de inflamación, sintomatología y tolerancia. Combina conceptos de dieta mediterránea, control glucémico, rotación de alimentos y estrategias de microbiota.
El verdadero objetivo
Más que seguir un “modelo”, lo esencial es crear un patrón de alimentación sostenible, antiinflamatorio y emocionalmente saludable. Comer despacio, con horarios regulares, en calma, sin miedo y con placer, también forma parte de los tratamientos para la EII. Porque el cómo comes es casi tan importante como el qué comes.
Además, muchos pacientes con EII arrastran miedo a ciertos alimentos, lo que puede generar déficits nutricionales, ansiedad alimentaria o desnutrición funcional. Por eso, la educación nutricional y el acompañamiento emocional son igual de relevantes que la dieta en sí.
En resumen, la nutrición no es un extra. Es un tratamiento con mayúsculas. Y bien enfocada, puede ayudarte no solo a reducir brotes, sino a recuperar fuerza, energía y confianza en tu cuerpo. Como todo en la EII: individualizado, adaptado y con propósito.
Técnicas mente-cuerpo
El intestino también piensa (y siente)
Cuando hablamos de tratamientos para la enfermedad inflamatoria intestinal, solemos pensar en pastillas, análisis, endoscopias o dietas. Pero hay algo más profundo que no se ve en las resonancias ni se mide con calprotectina: el sistema nervioso. Y es que la EII no es solo inflamación intestinal; es también una inflamación emocional, neurológica y muchas veces existencial. Por eso, las técnicas mente-cuerpo son un tratamiento real, aunque no vengan en una caja.
Diversos estudios han demostrado que el estrés crónico, la ansiedad anticipatoria o los traumas emocionales pueden desregular el eje intestino-cerebro, aumentar la permeabilidad intestinal y amplificar la respuesta inmunitaria. En otras palabras, un cuerpo inflamado suele acompañarse de una mente en alerta permanente. Y al revés.
Herramientas con evidencia
Dentro de los tratamientos para la EII más complementarios, las siguientes prácticas han demostrado beneficios reales:
- Meditación mindfulness: reduce la reactividad del sistema nervioso simpático, mejora la percepción del dolor, la calidad del sueño y la tolerancia al malestar digestivo.
- Respiración diafragmática: sencilla pero poderosa. Activa el nervio vago, regula la motilidad intestinal y ayuda a cortar ciclos de estrés físico y mental.
- Terapia de aceptación y compromiso (ACT): eficaz en enfermedades crónicas, mejora la relación con los síntomas sin necesidad de “luchar” contra ellos constantemente.
- Yoga suave y consciente: combina movimiento, respiración y presencia. Mejora digestión, reduce la inflamación de bajo grado y mejora el vínculo con el propio cuerpo.
- Técnicas de relajación guiada (ASMR, escaneos corporales, visualizaciones): útiles en brotes o momentos de pánico digestivo, especialmente por la noche.
Estas técnicas no reemplazan la medicación ni la dieta, pero pueden modular el origen de muchos síntomas y romper el bucle cuerpo-mente-síntoma que tantas veces alimenta la enfermedad. Porque en la práctica, muchas personas con EII no solo tienen intestinos inflamados: tienen nervios inflamados, pensamientos que tensan el abdomen y emociones que alteran el tránsito.
Integrar el trabajo emocional y nervioso dentro de los tratamientos para la enfermedad inflamatoria intestinal es una decisión inteligente, profunda y sostenida. No hace falta convertirse en monje zen ni practicar una hora al día: basta con elegir una práctica, sostenerla en el tiempo y dejar que el cuerpo aprenda a vivir sin miedo.
Comparativa entre enfoques
A medida que se han ido ampliando los recursos terapéuticos, cada vez se hace más importante entender qué enfoque usar en qué momento, y con qué objetivo. No todos los tratamientos para la enfermedad inflamatoria intestinal sirven para lo mismo, ni tienen el mismo perfil de acción, tolerancia o efecto a largo plazo.
Aquí te presento una comparativa clara entre los enfoques farmacológicos, las nuevas terapias emergentes y los tratamientos complementarios, para ayudarte a entender qué papel juega cada uno en la gestión de la EII:
Comparativa general por enfoque
| Enfoque | Utilidad principal | Inicio de acción | Ventajas clave | Limitaciones / Riesgos |
|---|---|---|---|---|
| Farmacológicos clásicos | Control de brotes, mantenimiento, prevención de recaídas | Rápido a medio plazo | Accesibles, protocolos claros, eficacia demostrada | Efectos secundarios sistémicos, resistencia o pérdida de eficacia |
| Terapias emergentes | Casos refractarios, intolerancia a otros fármacos | Rápido (JAKi) o medio (biológicos) | Alta especificidad, mejor tolerancia, innovación terapéutica | Aún costosos, posibles efectos inmunes, no disponibles en todos los centros |
| Tratamientos complementarios | Mejora de calidad de vida, apoyo al tratamiento base | Progresivo (acumulativo) | Bajo riesgo, integradores, trabajo sobre el terreno emocional y digestivo | Requieren constancia, personalización, no sustituyen fármacos en brote activo |
¿Cuál elegir?
Elegir entre los distintos tratamientos para la enfermedad inflamatoria intestinal no es una cuestión de “lo más nuevo” o “lo más natural”, sino de ajustar la herramienta adecuada al momento y al perfil de cada paciente:
- En brotes graves, los corticoides o biológicos anti-TNF siguen siendo los más eficaces.
- Para mantener la remisión, muchas veces basta con aminosalicilatos o inmunomoduladores.
- Si el paciente no responde o rechaza efectos adversos, los nuevos biológicos y las pequeñas moléculas ofrecen una alternativa más selectiva.
- Los suplementos como glutamina, proteína o cúrcuma, y las intervenciones como la dieta o la meditación, son piezas que completan el puzle, pero no lo reemplazan.
El mayor error es depender de un solo enfoque. La mejor estrategia es integradora: combinar lo farmacológico con lo nutricional, lo emocional con lo físico, lo médico con lo humano.
Cómo elegir el mejor tratamiento para la EII
Factores clave a tener en cuenta
No existe un único camino correcto cuando se trata de tratamientos para la enfermedad inflamatoria intestinal. Lo que sí existe es un criterio clave: individualización. Cada paciente tiene una historia, una biología y unas circunstancias distintas. Por eso, el tratamiento ideal es aquel que se adapta a esa persona concreta, en esa fase concreta, con ese tipo de respuesta concreta.
Elegir bien el tratamiento no siempre significa elegir lo más potente. A veces lo mejor es lo más sostenible. O lo que genera menos efectos adversos. O lo que mejor se adapta al estilo de vida del paciente. El éxito no es solo inducir la remisión; es mantenerla sin deteriorar la calidad de vida.
Aquí algunos factores clave a tener en cuenta a la hora de decidir entre los distintos tratamientos para la EII:
1. Tipo de EII y localización
- La colitis ulcerosa responde mejor a aminosalicilatos y tiene más evidencia con trasplante de microbiota fecal.
- La enfermedad de Crohn, especialmente con afectación ileal o fístulas, suele requerir inmunosupresores y biológicos más específicos.
- En formas perianales, estenosantes o fistulizantes, los anti-TNF (como infliximab) siguen siendo los más efectivos.
2. Fase de la enfermedad
- En brote agudo, la prioridad es frenar la inflamación (corticoides, biológicos).
- En remisión, se buscan tratamientos de mantenimiento seguros (aminosalicilatos, inmunomoduladores, dieta antiinflamatoria).
- En refractarios o multirresistentes, se consideran terapias emergentes como los JAKi o la medicina personalizada.
3. Perfil del paciente
- Edad, comorbilidades, historial de infecciones o deseo de embarazo influyen directamente en la elección.
- Pacientes con antecedentes de cáncer, infecciones severas o enfermedades autoinmunes deben evitar ciertas terapias inmunosupresoras.
- Las personas con alto nivel de estrés, ansiedad o fatiga crónica pueden beneficiarse más de un enfoque combinado con terapias mente-cuerpo y nutrición adaptada.
4. Respuesta previa y tolerancia
- Si un paciente no responde a un biológico, se puede cambiar de clase (de anti-TNF a anti-integrina, por ejemplo).
- Si hay efectos secundarios severos, se ajusta dosis, vía o incluso se pasa a estrategias complementarias mientras se recupera.
- Siempre se debe valorar la adherencia: un tratamiento mal tolerado o poco práctico no servirá aunque sea el más efectivo en teoría.
5. Enfoque integrador
El mejor resultado se obtiene cuando se combina un tratamiento médico eficaz con un estilo de vida que lo apoye:
- Alimentación personalizada.
- Suplementos con evidencia (como glutamina, creatina, proteína, cúrcuma o ashwagandha).
- Regulación emocional y del sistema nervioso.
- Movimiento adaptado, descanso y rutinas sostenibles.
Los tratamientos para la enfermedad inflamatoria intestinal no se eligen solo con protocolos. Se eligen con escucha, con criterio clínico y con sentido común.
Conclusión reflexiva
Hablar de tratamientos para la enfermedad inflamatoria intestinal es hablar de decisiones difíciles, de momentos de incertidumbre, de ensayos y errores… pero también de avances, opciones nuevas, remisiones largas y, sobre todo, de esperanza real y concreta.
La EII no tiene una cura definitiva hoy por hoy, pero sí tenemos herramientas cada vez más potentes y personalizables. Desde los medicamentos clásicos que aún salvan vidas, hasta los biológicos de última generación, las nuevas moléculas orales, los suplementos con evidencia o las estrategias de salud intestinal profunda como el TMF o la nutrición específica. Todo suma. Todo cuenta.
Lo más importante es comprender que no hay una única receta. Lo que para una persona es una solución, para otra puede ser un problema. Por eso, los mejores tratamientos para la EII no se basan solo en protocolos, sino en personas bien acompañadas, bien informadas y escuchadas. En decisiones compartidas. En estrategias que respeten no solo al intestino, sino al ser humano entero que hay detrás.
Cada brote enseña algo. Cada remisión refuerza una convicción. Cada síntoma pide un cambio, una revisión, un ajuste. Y cada paso consciente que das hacia tu bienestar —con tu médico, tu nutricionista, tu terapeuta, o contigo mismo— forma parte del tratamiento más poderoso: el que se construye desde el compromiso con tu salud y tu vida.
Porque al final, los tratamientos para la enfermedad inflamatoria intestinal no son solo para calmar el intestino. Son una oportunidad para reordenar todo lo demás.
Aminosalicilatos (5-ASA)
- Khan et al., 2011 – The Lancet
“5-Aminosalicylic acids for induction of remission in ulcerative colitis.”
Confirma su eficacia en colitis ulcerosa leve a moderada.
https://pubmed.ncbi.nlm.nih.gov/21296431
Corticoides
- Travis et al., 2006 – Gut
“Oral corticosteroids for moderate to severe ulcerative colitis: effective but with significant risks.”
Uso eficaz en brote agudo, pero con limitaciones por efectos adversos.
https://gut.bmj.com/content/55/12/1835
Inmunomoduladores
- Chande et al., 2015 – Cochrane Review
“Azathioprine or 6-mercaptopurine for maintenance of remission in Crohn’s disease.”
Útiles en mantenimiento, pero requieren monitorización estrecha.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6464522
Biológicos clásicos (anti-TNF)
- Rutgeerts et al., 2004 – NEJM
“Infliximab for maintenance of remission in Crohn’s disease.”
Altamente eficaces, especialmente en enfermedad perianal.
https://www.nejm.org/doi/full/10.1056/NEJMoa030815
Nuevos biológicos
- Feagan et al., 2013 – NEJM
“Vedolizumab as induction and maintenance therapy for ulcerative colitis.”
Alta eficacia y seguridad en colitis ulcerosa.
https://www.nejm.org/doi/full/10.1056/NEJMoa1215734 - Sands et al., 2019 – NEJM
“Ustekinumab as induction and maintenance therapy for Crohn’s disease.”
Aprobado para pacientes refractarios.
https://www.nejm.org/doi/full/10.1056/NEJMoa1809407
Inhibidores de JAK
- Sandborn et al., 2012 – NEJM
“Tofacitinib as induction and maintenance therapy for ulcerative colitis.”
Primer JAK aprobado para colitis; respuesta rápida y eficaz.
https://www.nejm.org/doi/full/10.1056/NEJMoa1606910
Trasplante de Microbiota Fecal (TMF)
- Paramsothy et al., 2017 – The Lancet
“Multidonor intensive faecal microbiota transplantation for active ulcerative colitis: a randomised placebo-controlled trial.”
Mejora la remisión clínica y endoscópica en colitis ulcerosa.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)30182-4/fulltext
Suplementación (glutamina, cúrcuma, creatina, proteína, ashwagandha)
Glutamina
- Ziegler et al., 2000 – JPEN
“Glutamine and the gastrointestinal tract.”
Apoya la integridad intestinal y reduce la permeabilidad.
https://pubmed.ncbi.nlm.nih.gov/11063064
Cúrcuma (Curcumina)
- Lang et al., 2015 – Clinical Gastroenterology
“Curcumin in combination with mesalamine is effective in inducing remission in patients with mild-to-moderate ulcerative colitis.”
Mejora de síntomas y remisión cuando se combina con 5-ASA.
https://pubmed.ncbi.nlm.nih.gov/26164680
Creatina
- Almeida et al., 2020 – Nutrients
“Creatine supplementation in inflammatory bowel disease: potential anti-inflammatory and mucosal barrier effects.”
Posible acción antiinflamatoria e intestinal protectora.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7352733
Ashwagandha
- Chandrasekhar et al., 2012 – Indian Journal of Psychological Medicine
Reducción del cortisol y mejora del estrés crónico.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3573577
Proteína
- Aunque no requiere ensayo específico por ser un macronutriente esencial, estudios en pacientes con EII muestran que la suplementación con batidos proteicos tolerables puede mejorar el estado nutricional y la recuperación de masa magra durante y después de brotes.
